Đề Thi HK 2 Môn Hóa 10- Đề 8
I/ Phần chung cho các ban : ( 8 điểm ) Câu 1 : ( 2 điểm)
Viết phương trình phản ứng thực hiện dãy chuyển hóa sau ( ghi rõ điều kiện phản ứng ) :
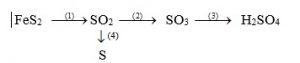
Câu 2 : (2 điểm)
Trình bày phương pháp hóa học phân biệt các dung dịch : NaCl , Na2SO4 , NaNO3 và H2SO4 đựng trong các lọ mất nhãn .
Câu 3 : (2 điểm)
Sắp xếp các chất : Br2 , Cl2 , I2 theo thứ tự tính oxi hóa giảm dần . Viết phương trình phản ứng minh họa và cho biết vai trò các chất tham gia phản ứng .
Câu 4 : ( 2 điểm )
Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch H2SO4 đặc , nóng , dư thì thu được 6,72 lít khí SO2 (đktc) .
a/ Viết các phương trình phản ứng xảy ra .
b/ Tính thành phần % về khối lượng của từng kim loại trong hỗn hợp ban đầu .
II/ Phần riêng cho các ban : ( 2 điểm ) 1/ Phần chỉ dành riêng cho chương trình chuẩn ( ban cơ bản và ban C ) :
Câu 5 a :
Xét hệ cân bằng sau trong một bình kín :
![]()
Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau. tại sao ? a/ Giảm nhiệt độ .b/ Thêm khí H2 vào .c/ Dùng chất xúc tác .
2/ Phần chỉ dành riêng cho chương trình nâng cao ( ban A ) :
Câu 5 b :
Cho phản ứng thuận nghịch : ![]()
a/ Ở một nhiệt độ nhất định , phản ứng trên đạt đến trạng thái cân bằng khi nồng độ các chất như sau : [N2] = 0,01 M ; [H2] = 2,0 M và [NH3] = 0,4 M . Tính hằng số cân bằng của phản ứng ở nhiệt độ đó .
b/ Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau ? tại sao ?
- Khi tăng nồng độ H2 .
- Khi giảm áp suất của hệ .
—————–Hết —————–
HƯỚNG DẪN CHẤM ĐỀ KIỂM TRA HỌC KÌ II
HÓA 10
I/ Phần chung cho các ban : ( 8 điểm ) Câu 1 🙁 2 đ) Viết phương trình phản ứng thực hiện dãy chuyển hóa sau ( ghi rõ điều kiện phản ứng ) :
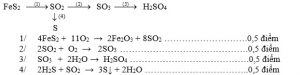
Câu 2 : (2 điểm) Trình bày phương pháp hóa học phân biệt các dung dịch : NaCl , Na2SO4 , NaNO3 và H2SO4 đựng trong các lọ mất nhãn .
Giải :
- Dùng quỳ tím : nhận biết được axit H2SO4 (hóa đỏ) 0,25 điểm
- Dùng BaCl2: nhận biết Na2SO4 (kết tủa trắng) 0,25 điểm
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl 0,5 điểm
- Dùng AgNO3: nhận biết NaCl (kết tủa trắng) 0,25 điểm
NaCl + AgNO3 → AgCl↓ + NaNO3 0,5 điểm
- Mẫu không phản ứng là NaNO3 0,25 điểm
Câu 3 : (2 điểm) Sắp xếp các chất : Br2 , Cl2 , I2 theo thứ tự tính oxi hóa giảm dần . Viết phương trình phản ứng minh họa và cho biết vai trò các chất tham gia phản ứng .
Giải :
- Thứ tự tính oxi hóa giảm dần : Cl2 > Br2 > I2 …………………………. 0,5 đ
- Phương trình phản ứng : Cl2 + 2 NaBr → NaCl + Br2 …………… 0,5 đ
(C. oh) (C.Khử ) ………………………………. 0,25 đ
Br2 + 2 NaI → NaBr + I2 ……………… 0,5 đ
(C. oh) (C.Khử )……………………………….. 0,5 đ
Lưu ý : Khi xđ vai trò của các chất tham gia : đúng cả 2 chất mới cho điểm : 0,25 đ
Câu 4 : ( 2 điểm ) Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch H2SO4 đặc , nóng , dư thì thu được 6,72 lít khí SO2 (đktc) .
a/ Viết các phương trình phản ứng xảy ra .
b/ Tính thành phần % về khối lượng của từng kim loại trong hỗn hợp ban đầu .
Giải :
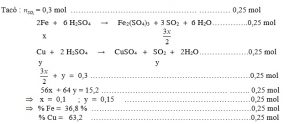
II/ Phần riêng cho các ban : ( 2 điểm ) 1/ Phần chỉ dành riêng cho chương trình chuẩn ( ban cơ bản và ban C ) :
Câu 5a :
Xét hệ cân bằng sau trong một bình kín :
![]()
Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau. tại sao ? a/ Giảm nhiệt độ . b/ Thêm khí H2 vào .c/ Dùng chất xúc tác .
Giải :
a/ Giảm nhiệt độ :
- Cân bằng chuyển dịch theo chiều thuận ………………………….0,25 điểm
- Vì khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt ( tỏa nhiệt ) tức chiều thuận …………………………………………………………………………. 0,5 điểm
b/ Thêm khí H2 vào :
- Cân bằng chuyển dịch theo chiều nghịch …………………………0,25 điểm .
- Vì khi thêm H2 vào thì nồng độ H2 tăng , nên cân bằng chuyển dịch theo chiều làm giảm nồng độ H2 , tức chiều nghịch ……………………………………….. 0,5 điểm .
c/ Dùng chất xúc tác :
- Cân bằng không chuyển dịch ………………………………………….0,25 điểm
- Vì xúc tác không ảnh hưởng tới chuyển dịch cân bằng ………0,25 điểm
2/ Phần chỉ dành riêng cho chương trình nâng cao ( ban A ) :
Câu 5 b :
Cho phản ứng : ![]()
a/ Tính hằng số cân bằng của phản ứng , nếu ở trạng thái cân bằng nồng độ của NH3 là 0,30 M ; của N2 là 0,05 M và của H2 là 0,10 M .
b/ Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau ? tại sao ?
- Khi tăng nồng độ H2 .
- Khi giảm áp suất của hệ .
Giải :
![]()
- Viết công thức đúng : 0,5 điểm .
- Đúng đáp án : 0,5 điểm .
b/ Khi tăng nồng độ H2 cân bằng chuyển dịch theo chiều nghịch ……………………….0,25 điểm . vì cân bằng chuyển dịch theo chiều làm giảm nồng độ khí H2 , tức chiều nghịch ……. 0,25 điểm .Khi giảm áp suất của hệ thì cân bằng chuyển dịch theo chiều nghịch ……………….0,25 điểm. vì cân bằng chuyển dịch theo chiều làm tăng áp suất ( tăng số phân tử khí ) , tức chiều nghịch .0,25đ
Lưu ý :
- Không cân bằng và không ghi điều kiện phản ứng trừ ½ số điểm của phản ứng đó .
- Giải cách khác hợp lý vẫn hưởng chọn số điểm .




