Đề Thi Học Kỳ 2 Hóa 10- Đề 10
(Cho biết khối lượng nguyên tử các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S=32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80;I=127; Ag = 108; Ba = 137)
Câu 1: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là
A. ns2np4. B. ns2np3. C. ns2np5. D. ns2np6.
Câu 2: Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen đơn chất:
A. Tăng dần. B. Giảm dần. C. Không thay đổi. D. Vừa tăng, vừa giảm.
Câu 3: Công dụng nào sau đây không phải của NaCl?
A. Làm thức ăn cho người và gia súc. B. Điều chế Cl2, HCl, nước Javen.
C. Làm dịch truyền trong y tế. D. Khử chua cho đất.
Câu 4: Thuốc thử đặc trưng để nhận biết ra hợp chất halogenua trong dung dịch là:
A. AgNO3 B. Ba(OH)2 C. NaOH D. Ba(NO3)2
Câu 5: Cho hình vẽ mô tả thí nghiệm điều chế Clo từ MnO2 và dung dịch HCl như sau:
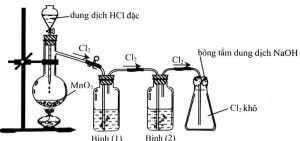
Khí Clo sinh ra thường lẫn hơi nước và khí hiđro clorua. Để thu được khí Clo khô thì bình (1) và bình (2) lần lượt đựng
A. Dung dịch H2SO4đặc và dung dịch NaCl. B. Dung dịch NaCl và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4đặc và dung dịch AgNO3. D. Dung dịch NaOH và dung dịch H2SO4 đặc.
Câu 6: Hòa tan hoàn toàn 91,35 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được V lít khí Cl2 (đktc). Gía trị của V là:
A. 19,6. B. 23,52. C. 15,68. D. 11,76.
Câu 7: Phương trình hóa học nào sau đây không thể xảy ra?
A. KBrdung dịch + Cl2 → B. NaIdung dịch + Br2 →
C. H2Ohơi nóng+ F2 → D. KBrdung dịch + I2 →
Câu 8: Cho 75 gam hỗn hợp X gồm CaCO3 và KHCO3 tác dụng vừa đủ với m gam dung dịch HCl 20% (d=1,2g/ml). Gía trị của m là:
A. 228,12. B. 82,5. C. 270. D. 273,75.
Câu 9: Cho 11,7 gam hỗn hợp bột Mg và Al tác dụng hết với dung dịch HCl dư thu được dung dịch Y và V lít khí H2 (đktc). Cô cạn dung dịch Y thu được 54,3 gam muối clorua khan. Gía trị của V là:
A. 10,08. B. 13,44. C. 3,36. D. 6,72.
Câu 10: Tính chất hóa học của axit clohiđric là:
A. Là axit mạnh, có tính oxi hoá, không có tính khử.
B. Là axit mạnh, có tính khử, không có tính oxi hoá.
C. Là axit mạnh, có tính oxi hoá, có tính khử, dễ bay hơi.
D. Là axit mạnh, có tính oxi hoá, có tính khử.
Câu 11: Phương trình hóa học nào dưới đây không đúng?
A. NaCl + AgNO3 → AgCl + NaNO3. B. HCl + AgNO3 → AgCl + HNO3.
C. 2HCl + Cu → CuCl2 + H2. D. 2HCl + FeS → FeCl2 + H2S.
Câu 12: Trong tự nhiên, Clo tồn tại chủ yếu dưới dạng
A. Khoáng vật sinvinit (KCl.NaCl). B. Đơn chất Cl2 có trong khí thiên nhiên.
C. Khoáng vật cacnalit (KCl.MgCl2.6H2O). D. NaCl trong nước biển và muối mỏ.
Câu 13: Vị trí của nguyên tố Oxi trong bảng tuần hoàn hóa học là
A. Ô thứ 8, chu kì 3, nhóm VIA. B. Ô thứ 8, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm VIA. D. Ô thứ 16, chu kì 2, nhóm VIA.
Câu 14: Muốn pha loãng dung dịch axit H2SO4 đặc cần làm như sau:
A. Rót từ từ dung dịch axit đặc vào nước. B. Rót từ từ nước vào dung dịch axit đặc.
C. Rót nhanh dung dịch axit đặc vào nước. D. Rót thật nhanh nước vào dung dịch axit đặc
Câu 15: Số oxi hoá của lưu huỳnh trong một loại hợp chất oleum H2S2O7 là:
A. -2. B. +4. C. +6. D. +8.
Câu 16: Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là:
A. Ozon. B. Clo. C. Oxi. D. Flo.
Câu 17: Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây:
A. KMnO4. B. NaHCO3. C. CaCO3. D. (NH4)2SO4.
Câu 18: Hãy chọn phát biểu đúng về oxi và ozon:
A. Oxi và ozon đều có tính oxi hoá mạnh như nhau.
B. Oxi và ozon đều có số proton và số notron giống nhau trong phân tử.
C. Oxi và ozon là các dạng thù hình của nguyên tố oxi.
D. Oxi và ozon đều phản ứng được với các chất như: Ag, KI, PbS ở nhiệt độ thường.
Câu 19: Ở phản ứng nào sau đây, H2S đóng vai trò chất khử ?
A. 2H2S + 4Ag + O2 → 2Ag2S + 2H2O. B. H2S+ Pb(NO3)2 → 2HNO3 + PbS.
C. 2Na + 2H2S2 → NaHS + H2. D. 3H2S+2KMnO4 → 2MnO2 +2KOH + 3S +2H2O.
Câu 20: Cho các phản ứng hoá học sau, phản ứng nào không xảy ra với chất tan trong dung dịch ?
A. SO2 + dung dịch NaOH → B. SO2 + dung dịch BaCl2 →
C. SO2 + dung dịch nước clo → D. SO2 + dung dịch H2S →
Câu 21: Cho 2,24 lít SO2 (đktc) hấp thụ hết vào 150 ml dung dịch NaOH 1M thu được dung dịch Y. Khối lượng muối có trong dung dịch Y là:
A. 11,5 gam. B. 12,6 gam. C. 10,4 gam. D. 9,64 gam.
Câu 22: Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là:
A. 60,87% B. 45,65% C. 53,26% D. 30,43%.
Câu 23: Hoà tan 13,44 gam một kim loại M có hóa trị không đổi bằng dung dịch H2SO4 loãng dư, thu được dung dịch Y và V lit khí H2 (đktc). Cô cạn dung dịch Y thu được 36,48 gam muối sunfat khan. Kim loại M là:
A. Mg. B. Al. C. Fe. D. Zn.
Câu 24: Có một loại quặng pirit chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn axit sunfuric 98% thì cần m tấn quặng pirit trên và biết hiệu suất của cả quá trình sản xuất H2SO4 là 90%. Gía trị của m là:
A. 69,44 tấn. B. 68,44 tấn. C. 67,44 tấn. D. 70,44 tấn.
Câu 25: Tốc độ phản ứng là:
A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu 26: Cho các yếu tố sau: (a) nồng độ chất; ( b) áp suất; (c) xúc tác; (d) nhiệt độ; (e) diện tích tiếp xúc.
Số yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là:
A. 2. B. 3. C. 4. D. 5.
Câu 27: Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45oC: N2O5 → N2O4 + 1/2O2. Ban đầu nồng độ của N2O5 là 4,66M, sau 368 giây nồng độ của N2O5 là 4,16M. Tốc độ trung bình của phản ứng tính theo N2O5 là
A. 2,72.10−3 mol/(l.s). B. 1,36.10−3 mol/(l.s). C. 6,80.10−4 mol/(l.s). D. 6,80.10−3 mol/(l.s).
Câu 28: Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học này sang trạng thái cân bằng hoá học khác do
A. Không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
B. Tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
C. Tác động của các yếu tố từ bên trong tác động lên cân bằng.
D. Cân bằng hóa học tác động lên các yếu tố bên ngoài.
Câu 29: Cho các cân bằng sau:
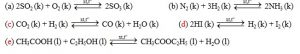
Số cân bằng hoá học đều không bị chuyển dịch khi tăng áp suất là:
A. 1. B. 2. C. 3. D. 4.
Câu 30: Cho phương trình phản ứng : 2A (k) + B (k) 2X (k) + 2Y (k). Người ta trộn 4 chất, mỗi chất 1 mol vào bình kín dung tích 2 lít (không đổi). Khi cân bằng, lượng chất X là 1,6 mol. Nồng độ B ở trạng thái cân bằng lần lượt là:
A. 0,7M. B. 0,8M. C. 0,35M. D. 0,5M.




